生物治疗药物领域取得了快速发展,抗体和类似抗体的形式成为治疗性蛋白质的一大类。对于生物技术领域的科学家和研究人员来说,了解抗体的结构和动态特性至关重要。这些见解为设计更有效的治疗性抗体和疫苗提供了信息。
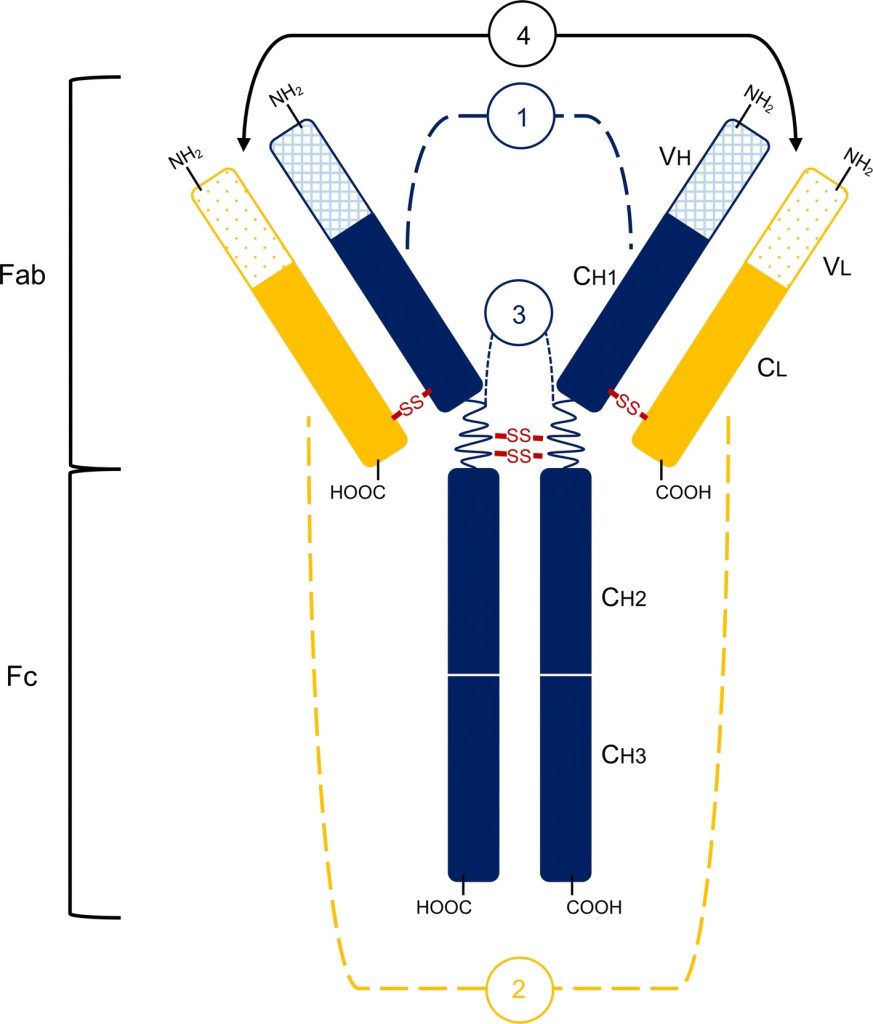
抗体是由两条相同的重链和两条相同的轻链组成的 Y 形分子。这种经典的 IgG 结构是模块化的,允许进行各种工程修饰,以增强生物物理特性和治疗潜力。抗体的“茎”形成可结晶片段 (Fc),参与与细胞表面受体的相互作用,而“臂”或抗原结合片段 (Fab) 包含负责抗原识别的可变结构域。抗体结构的一个重要部分是免疫球蛋白折叠(Ig-fold),这是各种蛋白质的保守特征。每个Ig样结构域由两个反平行的β片组成,这些片通过二硫键稳定。可变结构域(VH 和 VL)和恒定结构域(CH1-CL 和 CH3-CH3)分别形成异二聚体和同型二聚体,影响抗体的功能特性。
动力学在抗体功能中的作用
抗体不是静态结构;它们的动态特性是其功能的核心。分子动力学模拟揭示了抗体以构象集合的形式存在,在不同的时间尺度上会发生不同的重排。细微的运动,如键振动和侧链波动,发生在纳秒尺度上,而较大的环重排需要毫秒或更长时间。这种动态行为使抗体能够采用多种构象,从而增强了它们识别不同抗原的能力。
从氨基酸序列预测抗体结构仍然是一个挑战,特别是对于高变量互补决定区 (CDR) 环。传统的基于模板的方法,如同源建模,由于结构多样性而具有局限性。然而,混合方法和人工智能驱动的模型,如 AlphaFold2 和 DeepAB,在提高准确性方面显示出希望,尤其是对于 CDR 环路。通过核磁共振波谱和冷冻电镜等技术整合有关抗体动态性质的信息,可以进一步增强预测模型。
抗体工程的创新与实验技术
高分辨率结构技术,如 X 射线晶体学、NMR 波谱和冷冻电镜,有助于理解抗体-抗原识别。每种方法都有独特的优点。X 射线晶体学提供原子分辨率结构,NMR 波谱法捕捉溶液中的动力学,冷冻电子显微镜有助于在近生理条件下研究大型复合物。冷冻电子镜的最新进展,特别是分辨率革命,使其成为详细表位定位的首选方法。该技术可以处理异质样本,从而能够对多克隆抗体反应进行全面分析,并指导新型疗法的设计。
抗体工程导致了各种形式的发展,以满足多样化的治疗需求。例如,双特异性抗体可以同时识别两种不同的表位,从而增强其治疗潜力。工程技术可确保正确的重链和轻链配对,从而优化异源二聚化以获得所需的功能。较小的抗体形式,如单链可变片段 (scFv) 和二体抗体,在表达和药代动力学方面具有优势。这些形式保留了传统抗体的结合特异性,但具有更好的治疗应用特性。
参考资料:
- L., M., Pomarici, ND, Fischer, A., Hoerschinger, VJ, Kroell, KB, Riccabona, JR, Kamenik, AS, Loeffler, JR, Ferguson, JA, Perrett, HR, Liedl, KR, Han, J., & Ward, AB (2023).结构和动力学指导抗体疗法和疫苗的设计。抗体,12(4),67。https://doi.org/10.3390/antib12040067